Melanom (Kötü Huylu Ben)
Melanom derideki melanosit adı verilen hücrelerden gelişir. Melanositler deriye rengini veren melanin pigmenti üretirler. Melanom, diğer deri kanserleri olan bazal veya skuamöz hücreli karsinomdan daha az sıklıkta görülür. Ancak çok daha ölümcüldür.
Bildirilen melanom insidansı (görülme sıklığı), son 20-30 yılda önemli ölçüde artmıştır. Bu durum kısmen risk altındaki bireylerin UV ışığına maruz kalmasının artması ve kısmen de sıkı gözetim nedeniyle erken lezyonların daha fazla tespit edilmesi nedeniyledir.
Günümüzde, cilt melanomlarının en erken belirtilerine ilişkin artan kamu farkındalığının bir sonucu olarak, çoğu melanom erken evrede yakalanmakta ve cerrahi olarak tedavi edilebilmektedir.
PATOGENEZ (OLUŞUM MEKANİZMASI)
Derinin diğer kötü huylu tümörlerinde olduğu gibi, melanom da esas olarak UV ışığı kaynaklı DNA hasarından kaynaklanır. UV hücre mutasyonlarının kademeli olarak edinilmesine yol açar.
Görülme sıklığı güneşe maruz kalan ciltte, güneşe maruz kalmanın yüksek olduğu ve nüfusun çoğunun açık tenli olduğu coğrafi bölgelerde en yüksektir. Erken yaşta yoğun aralıklı güneşe maruz kalma en yüksek riski taşımaktadır. Kalıtsal yatkınlık da vakaların tahmini %5 ila %10’unda rol oynar. Nadir görülen ailevi melanom sendromuna sahip bireylerin incelenmesi bize bu tümörün gelişimi açısından değerli bilgiler vermektedir.
Ailevi geçişli melanomların %40 kadarında hücrenin mitotik bölünmesini durdurabilen CDKN2A lokusunda germ hattı mutasyonlar bulunur. Bu karmaşık lokus iki tümör baskılayıcı geni kodlar. p16, retinoblastom adlı tümör baskılayıcı proteini aktif durumda tutarak hücre döngüsünün G1-S geçişini düzenleyen bir siklin bağımlı kinaz inhibitörüdür. Yani p16 normal durumda mitozun G1-S fazının kontrol edilmesinde görev alır. p14 ise yine bir tümör baskılayıcısı olan p53’ün degradasyonunu (parçalanmasını) önleyerek aktivitesini artırır.
Melanom gelişiminin temel evreleri yatay ve dikey büyümedir. Melanom gelişiminin en erken tanınabilir evresinin dermoepidermal bağlantı boyunca melanositlerin lateral genişlemesinden oluştuğu ileri sürülmektedir. (lentijinöz hiperplazi ve junctional nevüs).
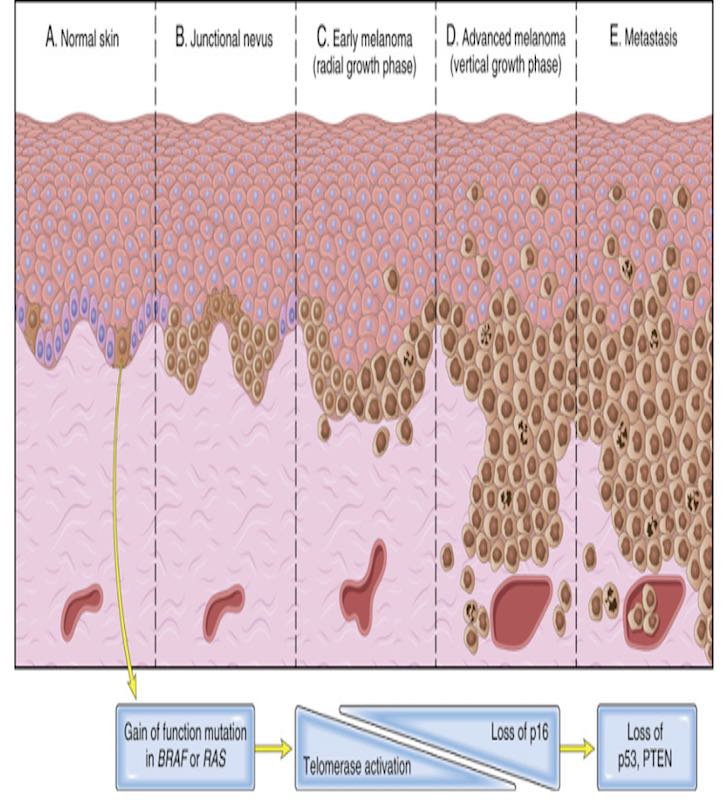
Bu lezyon daha sonra, genellikle uzun bir süre boyunca epidermis içinde radyal bir büyüme evresiyle erken melanomaya ilerler. Bu evrede, melanom hücreleri invazyon ve metastaz yapma kapasitesine sahip değildir.
Zamanla, tümörün hücresel olgunlaşmadan yoksun genişleyen bir kitle olarak daha derin dermal katmanlara doğru aşağı doğru büyüdüğü dikey bir büyüme evresi başlar. Bu olay genellikle daha önce düz bir lezyondan, nodülün gelişmesidir. Metastatik potansiyelin ortaya çıkmasıyla ilişkilidir. İyi huylu nevüslerden kaynaklandığı görülen vakalar da dahil olmak üzere ailevi ve sporadik vakaların DNA dizilimi, melanomun moleküler patogenezine ilişkin önemli bilgiler sağlamıştır.
Başlatıcı olay, BRAF veya (daha az yaygın olarak) RAS‘ta aktive edici bir mutasyon gibi görünmektedir. Vakaların büyük çoğunluğunda, diğer mutasyonlar üst üste gelmediği sürece bu yalnızca iyi huylu bir nevüs üretir. Melanom ve büyümenin radyal fazındaki melanomları düşündüren “atipik” morfolojik özelliklere sahip nevüslerin dizilenmesi, bunların genellikle telomeraz ekspresyonunu aktive eden ve yaşlanmayı (iyi huylu nevüslerin olağan kaderi) durdurduğu öne sürülen mutasyonlara sahip olduğunu göstermiştir.
Yani melanomlarda hücrelerin çoğalması ile birlikte çoğalan hücrelerin yaşlanmaması da tümör oluşumunda etkilidir. CDNK2A ve p16‘nın kaybına yol açan ek mutasyonlar veya epigenetik sapmalarla tümör, invaziv dikey büyüme fazına kayar. Tümör evriminin kutanöz fazı boyunca, UV ışığına maruz kalma mutasyon yükünü artırır. Tümör ilerlemesi şansını artırır.
Son olarak, TP53 ve PTEN gibi tümör baskılayıcı genlerdeki ek mutasyonlarla tümör metastaz kapasitesi kazanır. Bu fazda, aneuploidi ve genomik kopya sayısı değişiklikleri ortaya çıkar. Bu da evrimleşen tümörün genetik heterojenliğine katkıda bulunur.
Güneşe maruz kalmayan akral ve mukozal bölgelerde ortaya çıkan melanomalar daha az sıklıkta görülür. Bu tip melanomlar farklı moleküler seyirler izler. Bu tümörlerde yaygın bir başlatıcı olay, KIT reseptör tirozin kinaz genindeki bir fonksiyon kazanımı mutasyonudur. Benzer şekilde, gözün üveasında ortaya çıkan melanomlarda da bir dizi belirgin driver gen mutasyonu vardır. Bunların en dikkat çekeni, GTP bağlayıcı proteinler olan GNAQ veya GNA11‘i aktive eden mutasyonlardır.
Güneşe maruz kalan bölgelerde gelişen melanomlar, yüksek bir mutasyon yüküne sahiptir. Bunlardan bazıları neoantijenler oluşturan UV ışığı tarafından indüklenir. Buradan, melanomun gelişmesi için tümör hücrelerinin konak immün tepkisini bastırma (PD-1, PDL-1 ve CTLA-4) veya ondan kaçma yeteneği kazanması gerektiği sonucu çıkar.
Birçok ileri evre melanomlar immün check point inhibitörlerine yanıt verirler. Bu ajanlar susturulmuş melanom-spesifik T hücrelerini serbest bırakarak tümöre saldırmalarına izin verirler. Bu da tümör gelişiminde immün sistemden kaçışın önemini gösterir.
Özetle tümörü oluşturan basamakları engellemeye (BRAF, RAS, p16, p14, p53, PTEN) yönelik tedaviler akıllı ilaç tedavileri ve immün sistemimize tümör hücrelerini yok etme yeteneği kazandırma (PD-1, PDL-1 ve CTLA-4) immün check point inhibitörleri olarak bilinir. Cerrahi sonrası ya da cerrahi çansı olmayan melanomlarda bu tedaviler yaygın olarak kullanılmaktadır. Bu tedavilerin kullanılabilmesi için tümör hücresinin özelliklerinin bilinmesi gerekmektedir. Bu özellikler patoloji laboratuvarları tarafından yapılan bir takım testler ile ortaya konmaktadır.
MORFOLOJİ (GÖRÜNTÜ)
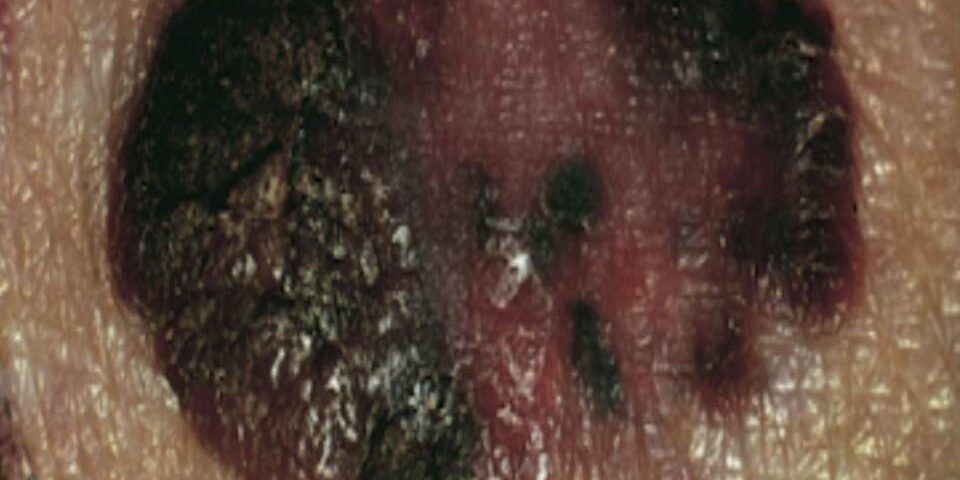
İyi huylu nevüslerin aksine, melanomlar genellikle siyah, kahverengi, kırmızı, koyu mavi ve gri tonları da dahil olmak üzere pigmentasyonda değişik varyasyonlar sergiler. Sınırları düzensizdir ve genellikle “çentiklidir.”
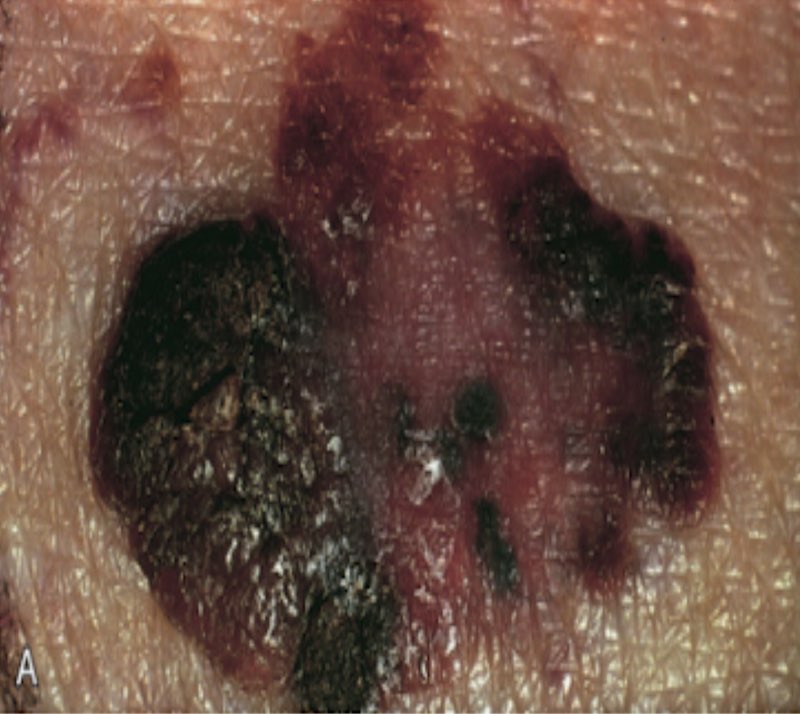
Mikroskobik olarak, atipik hücreler epidermisin tüm seviyelerinde (pagetoid yayılma) ve genişleyen dermal nodüllerde kötü oluşmuş yuvalar veya tek hücreler olarak büyür. Bunlar sırasıyla radyal (yatay) ve dikey büyüme fazlarını oluşturur.
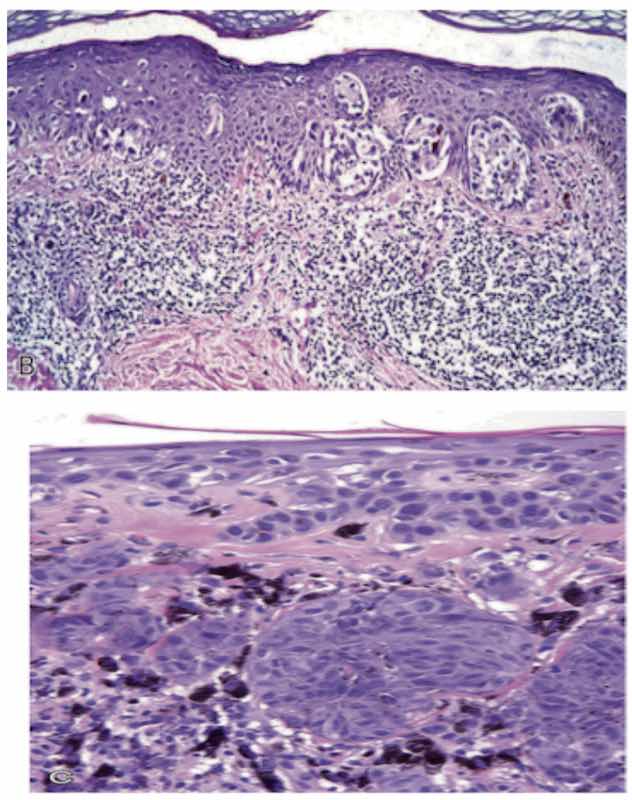
Yüzeysel yayılan melanomlarda genellikle canlı bir lenfositik (bağışıklık hücreleri) infiltrasyon vardır. Yani bağışıklık hücreleri tarafından kuşatılmıştır. Bu özellik tümör-spesifik antijenlere karşı bir konak yanıtını düşündürür.
Bu aşamada tümör hücrelerinde bulunan bazı proteinler, vücut tarafından zarar verici ajan olarak kabul edilerek bağışıklık sistemi devreye girer. Tümörün artan kalınlığı (dikey büyüme), daha kötü biyolojik davranışla güçlü bir şekilde ilişkilidir. Bu ve diğer değişkenleri toplu olarak kaydetmek ve rapor altına almak (patoloji raporu) tümörün davranışı hakkında doğru bilgileri vermektedir.
MİKROSKOPİK GÖRÜNTÜ
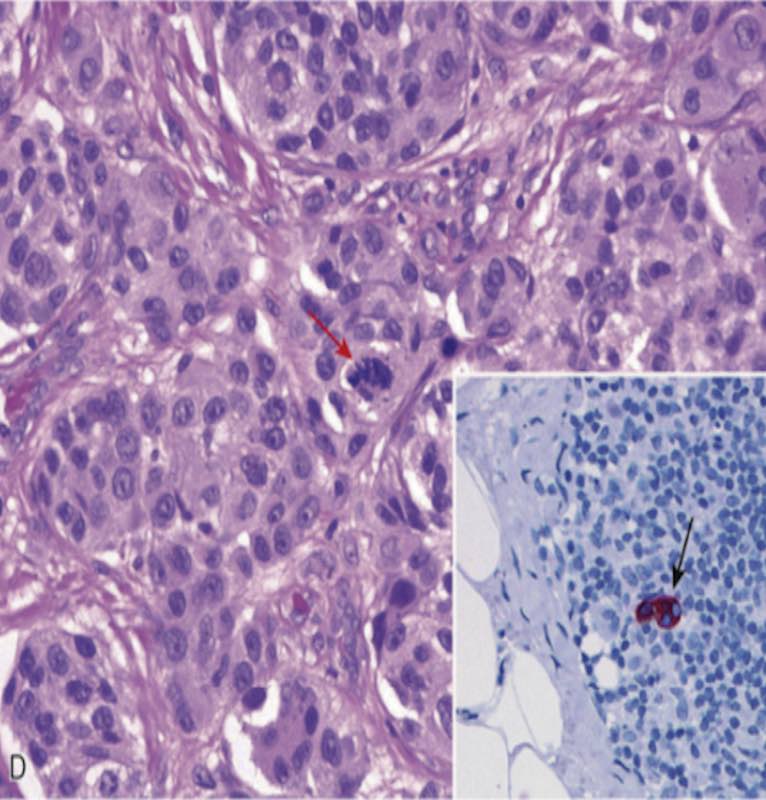
Melanom hücreleri genellikle nevüs hücrelerinden önemli ölçüde daha büyüktür. Tipik olarak düzensiz sınırlı büyük çekirdeklere, çekirdek membranın çevresinde karakteristik olarak kümelenmiş kromatine ve belirgin “kiraz kırmızısı” eozinofilik çekirdekçiklere sahiptirler. İmmünohistokimyasal olarak HMB45 ile pozitif boyanırlar. Metastatik lezyonların tanımlanmasında yardımcı olabilir.
KLİNİK ÖZELLİKLER
Bu lezyonların çoğu ciltte ortaya çıkar. Ancak, oral ve anogenital mukozal yüzeylerde, özofagusda, meninkslerde ve gözde de ortaya çıkabilirler. Deri melanomun insidansı cilt pigmentasyonunun derecesi ile ters orantılıdır. Melanom açık cilt tiplerine sahip kişilerde daha yaygındır. Melanom daha koyu cilt tiplerine sahip kişilerde, en sık ayak tabanında (akral melanom olarak adlandırılır), avuç içinde veya tırnak yatağında ortaya çıkar. Önemli klinik belirti, pigmentli bir lezyonun renginde veya boyutundaki değişikliktir.
Başlıca klinik belirtileri şunlardır:
- Önceden var olan bir nevüsün hızlı büyümesi
- Lezyonda kaşıntı veya ağrı olması,
- Erişkin yaşamda yeni bir pigmentli lezyonun gelişimi
- Pigmentli bir lezyonun sınırlarının düzensizliği
- Pigmentli bir lezyon içinde renk çeşitliliği
Bu ilkeler, melanomun sözde “ABCDE‘lerinde” ifade edilir:
Asimetri, sınır (border), renk (color), çap (diameter) ve mevcut bir nevüsün değişimi (evrim-evolution)
Melanomları tanımak ve mümkün olduğunca hızlı müdahale etmek hayati önem taşır. Yüzeysel lezyonların büyük çoğunluğu cerrahi olarak tedavi edilebilirken, metastatik melanom genellikle ölümcüldür.
Metastaz olasılığı, üstteki epidermisin granüler hücre tabakasının tepesinden dikey büyüme fazı nodülünün milimetre cinsinden invazyon derinliğinin ölçülmesiyle tahmin edilir. Breslow kalınlığı (mikroskopik olarak ölçülmelidir) olarak adlandırılır.
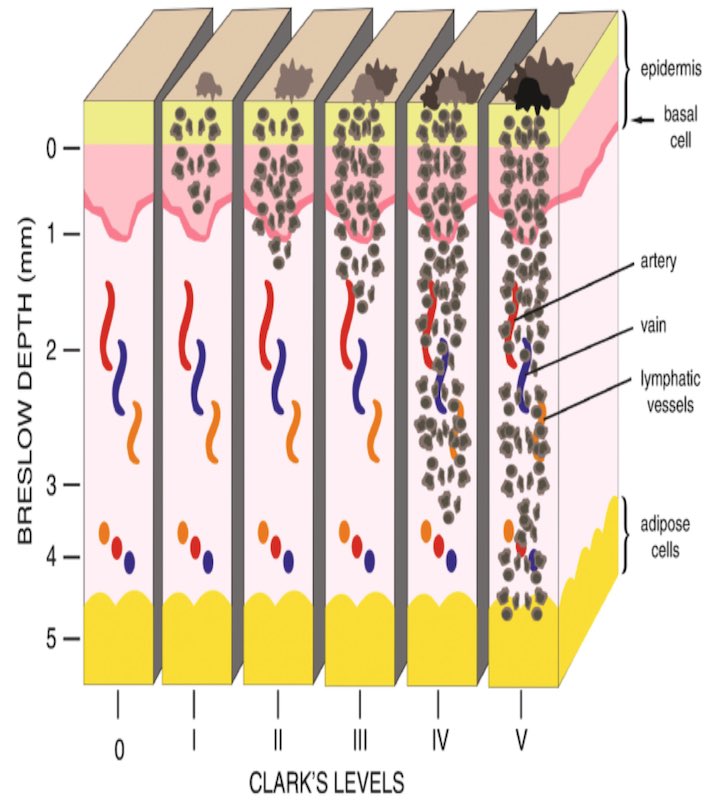
Metastaz riski, yüksek mitotik oranlı tümörlerde ve lokal bir bağışıklık tepkisi oluşturmayan tümörlerde de artar. Metastazlar yalnızca bölgesel lenf düğümlerine olmaz, karaciğer, akciğerler, beyin dahil olmak üzere vücudun her bölgesinde görülebilir.
Ameliyat sırasında sentinel lenf düğümü biyopsisi (birincil melanomun ilk drene olan düğümünün [düğümlerinin]) biyolojik saldırganlık hakkında ek bilgi sağlar. BRAF ve KIT’i seçici olarak inhibe eden ajanlar, BRAF ve KIT mutasyonları olan metastatik tümörlü hastalarda dramatik gerileme sağlar.
Ancak birçok tümör sonunda ilaç direncinin gelişmesi nedeniyle tekrarlar.